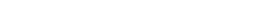Anvisa nega certificado de boas práticas para fabricante da vacina Covaxin
Uma resolução que comunica a decisão foi publicada no Diário Oficial da União desta terça (30)
© Getty Images

Brasil Pandemia
BRASÍLIA, DF (FOLHAPRESS) - Após inspeção em fábrica na Índia, a Anvisa (Agência Nacional de Vigilância Sanitária) decidiu indeferir o pedido de certificado de boas práticas de fabricação para a Bharat Biotech, empresa responsável pela vacina Covaxin.
O documento, que atesta que a empresa segue regras de fabricação necessárias para garantir a qualidade e a eficácia do produto, é um dos requisitos para que haja o registro de um medicamento ou vacina no Brasil. Informações sobre boas práticas também são exigidas para aval ao uso emergencial.
Uma resolução que comunica a decisão foi publicada no Diário Oficial da União desta terça (30).
Em nota, a Anvisa diz que o plano de ação enviado pela empresa "não é suficiente para mitigar todos os riscos envolvidos na fabricação da vacina no curto prazo". Por isso, negou o pedido.
A agência diz ainda que encontrou diferentes "não conformidades" na inspeção, "sendo três críticas, 12 maiores e 14 menores, que, em conjunto, denotam um risco significativo à fabricação e garantia de qualidade do produto, implicando em risco sanitário aos usuários".
O pedido para obtenção do certificado havia sido feito pela Precisa Medicamentos, laboratório que tem uma parceria com a Bharat Biotech. Em nota, a empresa disse que vai recorrer da decisão da Anvisa.
No fim de fevereiro, a Precisa fechou um acordo com o ministério da Saúde para fornecer 20 milhões de doses da vacina Covaxin ao Brasil. O valor do contrato foi de R$ 1,6 bilhão.
Cerca de um mês após a assinatura do contrato, a vacina ainda não tem aval para uso emergencial ou registro no país.
Na prática, a negativa do certificado de boas práticas indica que o cronograma do ministério deve ter novos atrasos. Calendário inicial previa a entrega de 8 milhões de doses ainda em março. Outros 8 milhões tinham previsão de entrega em abril, e 4 milhões em maio.
Dentro do ministério, no entanto, integrantes já apontavam que era difícil obter as doses ainda em março, dado o fato de que a empresa ainda não tinha solicitado aval à Anvisa para uso emergencial ou registro da vacina.
Recentemente, a Precisa chegou a anunciar que entraria com pedido de uso emergencial na Anvisa, mas, segundo a agência, isso não ocorreu.
Um pedido excepcional de autorização para importação das doses foi feito na última semana pelo ministério da Saúde, mas teve o prazo suspenso pela ausência de todos os documentos necessários para análise.
Uma visita de inspeção à fábrica da Bharat Biotech, na Índia, como parte da avaliação do pedido de certificado de boas práticas, foi feita no início deste mês. Ao todo, cinco servidores participaram do processo. Após essa etapa, foram verificados documentos.
Ainda em nota, a Anvisa diz a Precisa reconheceu, durante o processo, as observações indicadas pela equipe de inspeção e se propôs a resolver as falhas apontadas até 30 de julho deste ano.
"Entretanto, as medidas efetivamente adotadas até o momento não são suficientes para mitigar os riscos associados às não conformidades apontadas", diz a agência.
Entre os problemas verificados, estão o fato de que a empresa não utiliza um método de controle específico para quantificar a potência da vacina, o que pode afetar a eficácia do imunizante.
A agência diz ainda que a empresa não validou o método de análise que comprova que o vírus foi inativado durante a fabricação, o que traz riscos à segurança do produto, e que não houve comprovação de uma estratégia de controle para garantir a pureza da vacina.
Ainda em nota, como alternativa, a Anvisa diz que a Bharat Biotech poderá finalizar "todos os estudos, validações e processos previstos em seu plano de ação" e pedir à agência uma nova certificação.
"Neste momento, deverão ser apresentados os estudos e alterações propostas concluídos e efetivados na rotina fabril, o que permitiria a avaliação da Anvisa e, mediante resultados satisfatórios, a concessão da certificação da empresa", diz a Anvisa.
Questionada se a negativa traz um possível impeditivo a uso emergencial, a agência diz que, caso a empresa solicite esse aval, irá avaliar a documentação, "que pode conter dados complementares aos que foram avaliados nesse momento".
A existência de pontos que foram alvo de impasse e a previsão de fazer ajustes até julho de 2021, no entanto, indica que pode haver dificuldades nesse processo, segundo técnicos ouvidos pela reportagem.
OUTRO LADO
Procurada pela reportagem, a Precisa informou, em nota, que vai recorrer da decisão da Anvisa em conjunto com a Bharat Biotech, "apresentando novamente todos os prazos de ajustes revisados e as evidências de todos os processos adequados já realizados para a obtenção do certificado".
A empresa diz ainda que tem procurado atender a todas as determinações da Anvisa. Diz ainda que "tentou, antes de todos os prazos, sanar da melhor maneira possível todas as questões [apontadas pela Anvisa], bem como se apresentou aberta para todos os ajustes".
Para a Precisa, o atendimento dos pontos apontads pela agência em menor prazo "somente seria possível interrompendo a produção da Covaxin de forma completa, consequentemente afetando o suprimento para países que já vêm recebendo o produto e já autorizaram o uso emergencial do mesmo, o que é extremamente incoerente e imprudente nesta atual situação mundial".
Atualmente, a Covaxin é usada na Índia e em outros quatro países (Irã, Myanmar, Guiana, Zimbabue e Ilhas Maurício). A vacina apresentou, em dados preliminares, eficácia de 80,6% em testes clínicos da fase 3.

 PORTUGAL
PORTUGAL