Anvisa diz que recebeu pedido de uso emergencial da Precisa para vacina Covaxin
A solicitação é da empresa Precisa Medicamentos - que se tornou alvo da Comissão Parlamentar de Inquérito (CPI) da Covid, no Senado, que quebrou os sigilos de um dos sócios, Francisco Maximiano
© Getty Images

Brasil Covaxin
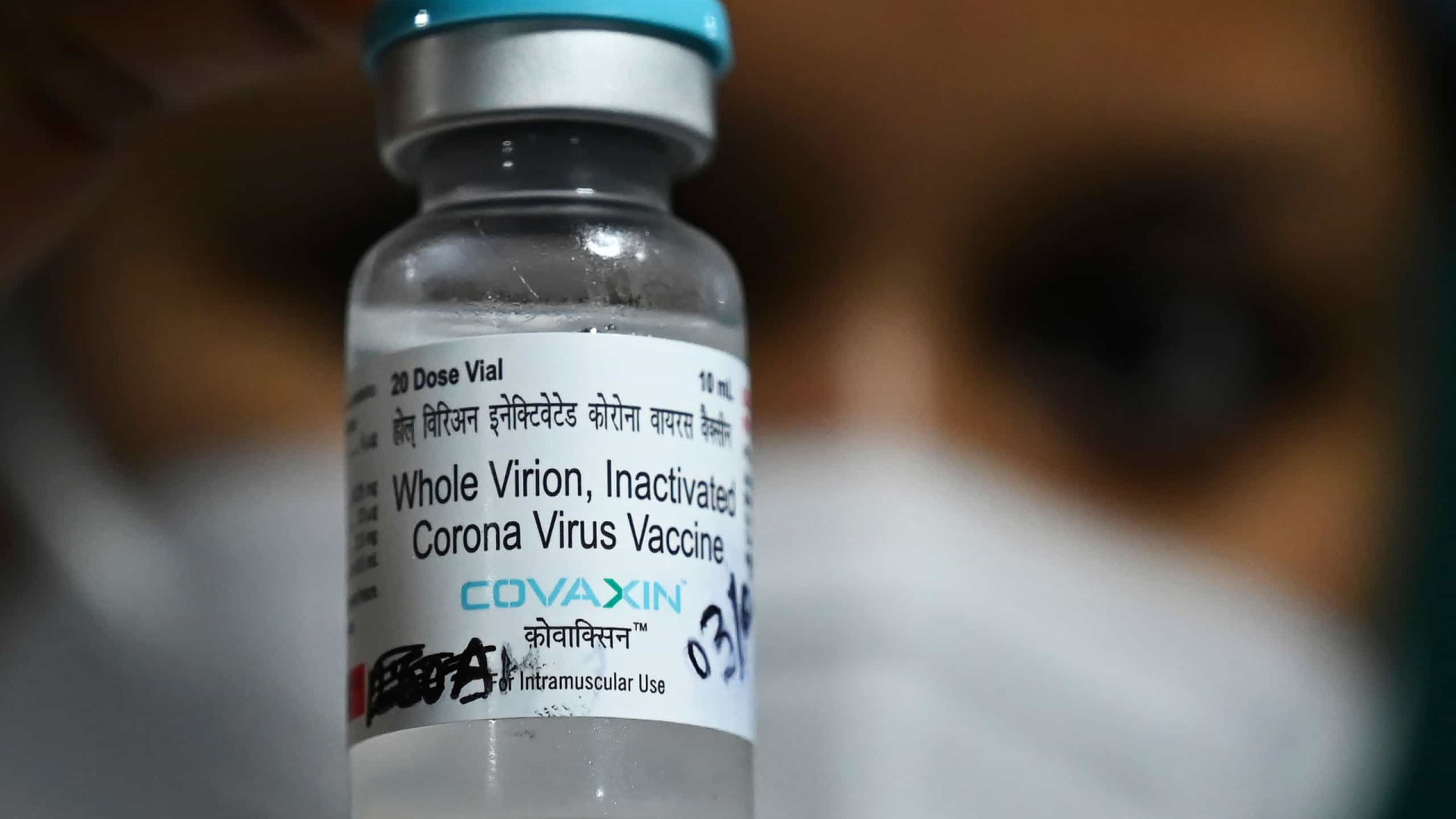
A Agência Nacional de Vigilância Sanitária (Anvisa) informou o recebimento, nesta terça-feira (29), do pedido de uso emergencial em caráter experimental da vacina Covaxin, da farmacêutica indiana Bharat Biotech. A solicitação é da empresa Precisa Medicamentos - que se tornou alvo da Comissão Parlamentar de Inquérito (CPI) da Covid, no Senado, que quebrou os sigilos de um dos sócios, Francisco Maximiano.
A empresa foi alvo do Ministério Público Federal (MPF) sob acusação de fraude na venda de testes para covid-19. Na semana passada, o MPF viu indícios de crime na contratação da vacina indiana Covaxin pelo governo de Jair Bolsonaro. O preço fechado para a compra do imunizante, de US$ 15 por dose, foi 1.000% mais alto do que o estimado pela própria fabricante, seis meses antes.
Segundo a Anvisa, as primeiras 24 horas após o pedido do uso emergencial da Coxavin serão utilizadas para fazer uma triagem do processo e verificar se os documentos necessários para avaliação estão disponíveis. Se houver informações importantes faltando, a Anvisa pode solicitar as informações adicionais ao laboratório.
Para a avaliação, a agência vai utilizar as informações apresentadas junto com o pedido e também os dados encaminhados anteriormente. O prazo de análise do pedido pode ser sete ou 30 dias, a depender do caso específico.
"Pela norma, o prazo de avaliação será de sete dias quando houver desenvolvimento clínico da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitária estrangeira seja capaz de comprovar que a vacina atende aos padrões de qualidade, de eficácia e de segurança estabelecidos pela OMS ou pelo ICH e pelo PIC/S", comunica a Anvisa em nota.
Segundo, a agência reguladora, o prazo de avaliação do pedido de uso emergencial não considera o tempo do processo em status de exigência técnica, que é quando o laboratório precisa responder questões técnicas feitas pela agência dentro do processo.

 PORTUGAL
PORTUGAL